杜克大学和圣路易斯华盛顿大学的研究人员说,不幸的是,生物学上的“前馈”环驱动关节炎关节中的软骨细胞实际上促进了疾病的发展。
杜克大学神经病学教授,疼痛研究人员和力学生物学家沃尔夫冈·利特克(Wolfgang Liedtke)与杜克大学前同事和软骨专家Farshid Guilak(现在在华盛顿大学医学院)合作,研究了软骨中压力敏感离子通道的活性。他们的研究出现在3月22日那周的《美国国家科学院院刊》上。
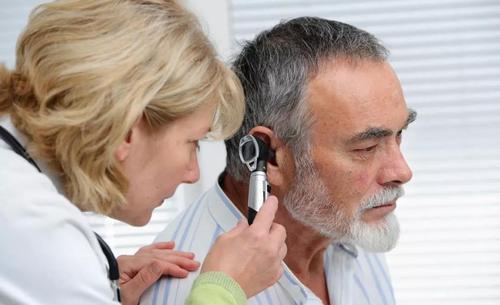
软骨是一种高度润滑,低摩擦的弹性组织,可衬砌关节表面,缓冲运动并吸收数百万次机械压缩循环。由于软骨在痛苦的骨关节炎中破裂,骨头的末端可以在骨头上汇聚在一起,从而使疼痛更加加重。
建立并维持软骨的细胞称为软骨细胞,在其表面可以发现对力敏感的离子通道,称为Piezo1和Piezo2。响应关节上的机械负载,压电通道将信号发送到细胞中,从而可以改变该细胞中的基因活性。
通常,软骨细胞会产生细胞外基质,结构蛋白和其他生物分子,从而赋予软骨机械强度,弹性和低摩擦力。但是在骨关节炎中,这些细胞的变性和功能失调(无法通过细胞分裂修复)会导致软骨的逐渐破坏。
骨关节炎的其他标志之一是慢性低度炎症,这种炎症是由称为白细胞介素-1α的信号分子驱动的。研究人员希望利用猪和人关节软骨细胞进行替换手术,以观察炎症如何影响软骨细胞。
他们发现白介素信号传导告诉细胞产生更多的压电通道,使细胞对压力更加敏感,并导致研究人员称之为有害的“前馈”回路,从而导致更多的软骨破裂。
Liedtke说:“白细胞介素可重新编程软骨细胞,使它们对机械损伤更敏感。”“前馈周期将它们缓慢磨碎,无法更换电池。”
Liedtke将健康的软骨细胞描述为有弹性的球体,“像网球一样”,其肌动蛋白纤维的内部基质使其保持僵硬。但是,由于这些细胞失去了替代肌动蛋白纤维的能力,“它们变得更柔软,更柔软”。
不幸的是,研究人员发现,它们变得越松散,就会产生更多的压电通道。
 生物帮
生物帮