在亨廷顿舞蹈病中,有缺陷的蛋白质聚集在脑细胞中并最终杀死它们。原则上,可以用热激蛋白防止这种蛋白聚集。然而,还不清楚这些蛋白质如何与亨廷顿舞蹈病蛋白质相互作用。

荷兰格罗宁根大学的帕特里克·范·德·韦尔(Patrick van der Wel)和德克萨斯大学的同事进行的新研究已部分解决了与这类聚集蛋白结合的热激蛋白的结构,从而帮助我们了解它们的工作原理。结果发表在2月11日的“自然通讯”杂志上。
热休克蛋白(Hsp)由暴露于压力条件下的细胞产生。Hsp家族是多种多样的,并且相当多的蛋白质起伴侣蛋白的作用。这意味着它们可以帮助其他蛋白质以正确的方式折叠(或在受损后重新折叠)。
这些蛋白质可以帮助折叠成千上万种不同的蛋白质。为此,他们使用具有特定结合能力的协同分子。”
格罗宁根大学固态NMR光谱学副教授Patrick Van der Wel
已订购
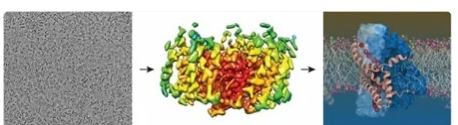
一类热激蛋白Hsp40有助于抑制像亨廷顿氏病中出现的蛋白质聚集。这些Hsp40蛋白有不同的种类,其中一些会与具有很多重复谷氨酰胺氨基酸的聚集蛋白特异性结合,例如在亨廷顿舞蹈病中发现的有缺陷的蛋白。这些Hsp40蛋白之一称为DnaJB8,这是Van der Wel和他的同事研究的蛋白。
Van der Wel说:“为了了解DnaJB8的作用,我们需要知道它的外观。”但是,很难解析这种蛋白质的结构。他继续说:“它看起来像是二聚体或寡聚体,因此这些蛋白质单元中的许多可以协同工作,但它们的结构并不是真正有序的。”这使得不可能使用全部需要有序结构的标准技术。
 生物帮
生物帮