德克萨斯州休斯顿-2021年3月25日-人类出生时就有成千上万的造血干细胞(HSC),这些造血干细胞共同确保血液和免疫细胞的终生生成,从而保护我们免受感染。HSC可以复制以产生更多的干细胞后代,也可以分化以产生独特的免疫细胞谱系,这是一个极为关键的决定,可确保人体在拥有足够的免疫细胞与侵略者抗衡的同时,又保留足够的HSC来维持未来的血液生成,实现良好的平衡。 。随着年龄的增长,HSC积累的突变会导致遗传上不同的亚群的出现。这种常见的现象称为克隆性造血(CH),已知于五十年代早期开始,通常与DNMT3A基因功能突变的丧失有关。
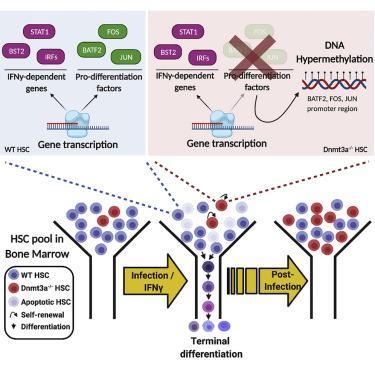
由贝勒医学院和德克萨斯儿童医院副教授凯瑟琳·金博士领导的一项研究首次表明,长期感染和慢性炎症驱动Dnmt3a功能丧失介导的CH。此外,该研究提供了对慢性炎症导致CH的机制的关键见解,并证明了DNMT3a在调节正常HSC对感染的反应中的关键作用。这项研究发表在“细胞干细胞”杂志上。
“以前,我们表明慢性感染严重损害了野生型HSC保持静止的干细胞状态的能力。长时间(持续数月)暴露于系统性细菌感染促进了HSC的广泛分化。尽管这会产生足够的免疫细胞为了对抗这种感染,它还使骨髓HSC的数量减少了90%。”“相比之下,缺乏Dnmt3a基因的小鼠中的HSC分化不大。事实上,它们经历了自我更新以产生更多的HSC。我们进行了这项研究,以检验我们的预测,即Dnmt3a HSC的分化缺陷和重复性增加使它们能够被超越在应对慢性感染或面临长期炎性疾病时,应胜过正常的HSC。”
为了检验他们的假设,研究人员使用实验和数学建模实验相结合的方法来测试Dnmt3a突变小鼠的HSC对长期感染和慢性炎症的反应。为了进行实验验证,他们生成了镶嵌小鼠,这些镶嵌小鼠是通过将来自Dnmt3a突变小鼠和正常小鼠的全骨髓混合物移植到受辐照的小鼠中而产生的,这使他们能够追踪HSC的每个亚群如何随着时间的推移彼此收缩或相对生长当被鸟分枝杆菌感染数月后。
 生物帮
生物帮