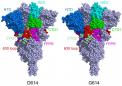
波士顿-2021年3月16日-迅速传播的英国,南非和巴西的冠状病毒变种引起了人们的关注,也引发了人们对COVID-19疫苗能否预防这种病毒的担忧。波士顿儿童医院的Bing Chen博士领导的新工作分析了冠状病毒刺突蛋白的结构如何随D614G突变(由所有三个变体携带)而改变,并说明了为什么这些变体能够更快地传播。该团队在《科学》杂志上报告了其发现结果(2020年3月16日)。
Chen的团队使用低温电子显微镜(cryo-EM)对尖峰进行了成像,其分辨率可降至原子级。他们发现,与原始的SARS-CoV-2病毒相比,D614G突变(以尖峰蛋白的遗传密码替换为单个氨基酸“字母”)使尖峰更加稳定。结果,更多的功能性突峰可与我们细胞的ACE2受体结合,使病毒更具感染力。
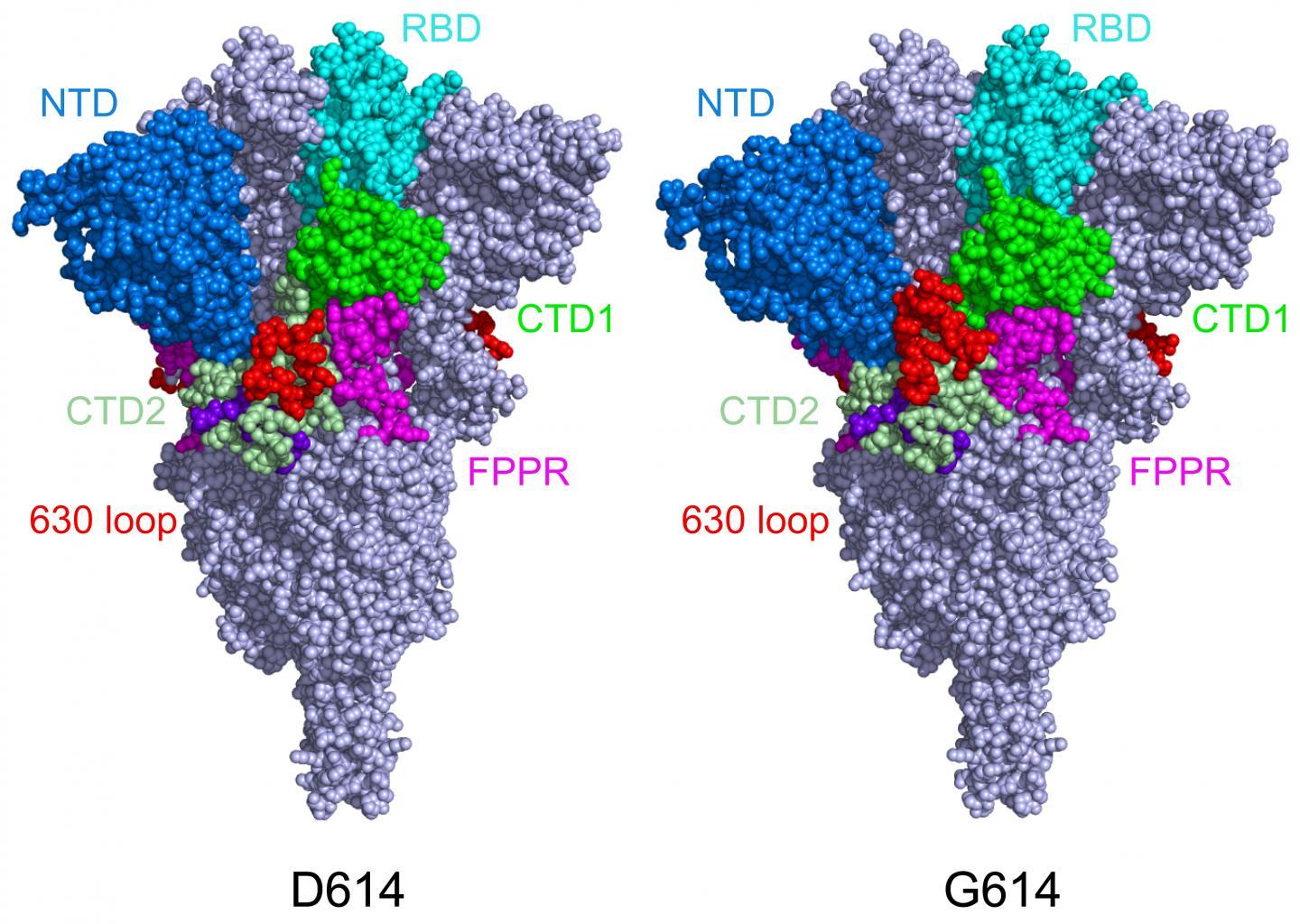
防止尖峰形状改变
在最初的冠状病毒中,刺突蛋白会与ACE2受体结合,然后急剧改变形状,并自身折叠。这使病毒能够将其膜与我们自己细胞的膜融合并进入内部。但是,正如Chen和他的同事在2020年7月所报道的那样,尖峰有时会过早地改变形状,并在病毒与细胞结合之前就消失了。虽然这减慢了病毒的速度,但形状的变化也使我们的免疫系统更难以包含病毒。
Chen说:“由于原始的刺突蛋白会解离,因此不足以诱导强烈的中和抗体反应。”
当Chen和同事对突变的刺突蛋白进行成像时,他们发现D614G突变通过阻止过早的形状变化来稳定刺突。有趣的是,该突变还使刺突与ACE受体的结合更弱,但刺突较不易过早脱落的事实使病毒总体更具感染性。
“说原始病毒有100个峰值,” Chen解释说。“由于形状不稳定性,您可能只有50%起作用。在G614变体中,您可能有90%起作用,因此,即使它们也没有结合,您获得的可能性更大。感染。”
Chen建议重新设计的疫苗应包含此突变体突突蛋白的代码。他说,更稳定的峰状形状应该使基于峰的任何疫苗(如Moderna,Pfizer和Johnson&Johnson疫苗)都更有可能引起保护性中和抗体。
 生物帮
生物帮